君實生物在中國上海成立。
君實生物成立於2012年12月,是一家以創新為驅動,致力於創新療法的發現、開發和商業化的生物製藥公司。
憑藉卓越的創新藥物發現能力、先進的生物技術研發、全產業鏈大規模生產科技和極具市場潜力的在研藥品組合,君實生物在腫瘤免疫療法,以及自身免疫性疾病、代謝類疾病、神經系統疾病、傳染性疾病等治療方面極富潜力。
我們的使命
憑藉强大的研發能力並立足醫療創新的前沿,君實生物以“用世界一流、值得信賴的創新藥普惠患者”為使命。
-
為患者提供效果更好、花費更優的治療選擇
-
通過源頭創新來開發首創(first-in-class)或同類最優(best-in-class)的藥物
-
成為轉化醫學領域的先鋒
-
滿足醫療需求和治癒病患
發展戰略
-
快速拓展產品管線
-
專注於在研藥品的推進和商業化
-
提高大分子發酵產能,降低生產成本
我們致力於成為一家集研發、生產和商業化於一體,並具有全球競爭力的全產業鏈創新型生物製藥公司。
發展歷程
年份
2012
- 2025
- 2024
- 2023
- 2022
- 2021
- 2020
- 2019
- 2018
- 2017
- 2016
- 2015
- 2014
- 2012
核心團隊
全球化佈局
立足中國,佈局全球。
君實生物從上海的全球總部出發,在中國上海、蘇州、美國舊金山和馬里蘭設立四個研發中心,在蘇州吳江和上海臨港建有兩個生產基地,在全球擁有約兩千五百名員工。
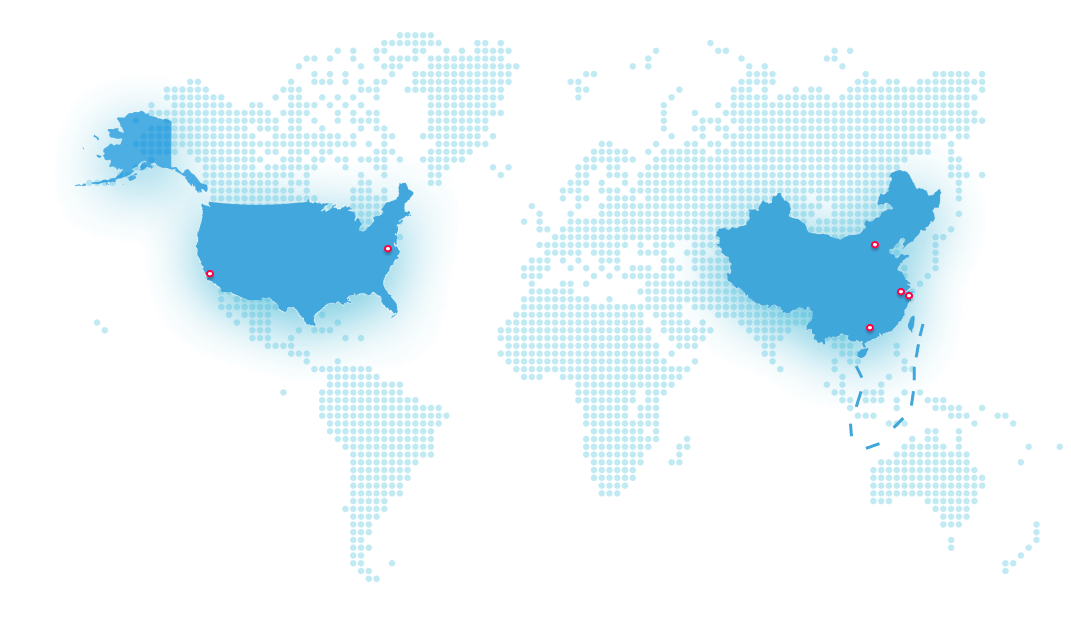
全球總部
上海研發中心
- 靶點發現與驗證
- 候選分子篩選與優化
- 工藝與分析方法開發
- 技術轉移
- 藥物註冊與臨床開發
上海臨港生產基地
- 穩轉細胞株的建立
- 工藝優化
- CGMP標準生產
- 全球質量系統的建立和維護
- 臨床試驗用藥和商業化生產
蘇州研發中心
- 在研藥品的功能學驗證與工藝開發
- 中試生產
蘇州吳江生產基地
- 穩轉細胞株的建立
- 工藝優化
- GMP標準生產
- 全球質量系統的建立和維護
- 臨床試驗用藥和商業化生產
馬里蘭研發中心
- 新靶點篩選
- 功能性抗體篩選
- 分析方法開發
- 技術轉移
- 藥物註冊與臨床開發
舊金山研發中心
- 新靶點篩選
- 候選分子篩選
- 分析方法開發
- 臨床生物標誌物研究
- “生物信息學+AI”新藥研發
- 多組學數據挖掘