君實生物新冠口服藥民得維®第2項三期研究結果榮登《柳葉刀-感染病學》
北京時間2023年11月23日,國際感染病學期刊排名第一的《柳葉刀-感染病學》(The Lancet Infectious Diseases,影響因子:56.3)發佈了國產新冠口服藥民得維®(氫溴酸氘瑞米德韋片,產品代號:VV116/JT001)的一項Ⅲ期臨床研究的完整結果。據瞭解,這是首個在國際頂級醫學期刊發表的國產新冠口服藥Ⅲ期註冊臨床研究結果,也是繼2022年底民得維®實現首個中國自主研發的新冠創新藥臨床試驗結果首登國際頂級醫學期刊《新英格蘭醫學雜誌》(NEJM,影響因子:158.5)之後,第二項獲得國際學術界認可的Ⅲ期臨床研究。基於該研究,民得維®已於今年1月在中國獲批用於治療輕、中度COVID-19成年患者。

本次發表基於一項多中心、隨機、雙盲、安慰劑對照、Ⅲ期臨床研究(NCT05582629),由浙江大學傳染病診治國家重點實驗室主任李蘭娟院士牽頭,在全國31家中心開展。李蘭娟院士為論文的通訊作者,上海市公共衛生臨床中心范小紅教授和淩雲教授,浙江樹人大學樹蘭國際醫學院附屬樹蘭(杭州)醫院戴霞紅教授、吳麗花教授和湯靈玲教授作為共同第一作者。
該研究在期中分析階段即已獲得具有統計學意義和臨床意義的顯著結果,與安慰劑相比,民得維®治療輕、中度新冠病毒感染成人患者(≥18歲)可顯著縮短咳嗽、流涕、發熱、腹瀉等11項臨床症狀的消失時間,中位時間比安慰劑組縮短2天(HR=1.21,P=0.0023)。最終分析結果與期中分析一致,症狀消失中位時間比安慰劑組縮短2天(HR=1.17,P=0.0009),為國內外新冠口服藥已報導資料中表現最優,進一步證明了民得維®的療效獲益。60歲以上老年患者的亞組分析資料與整體人群一致。
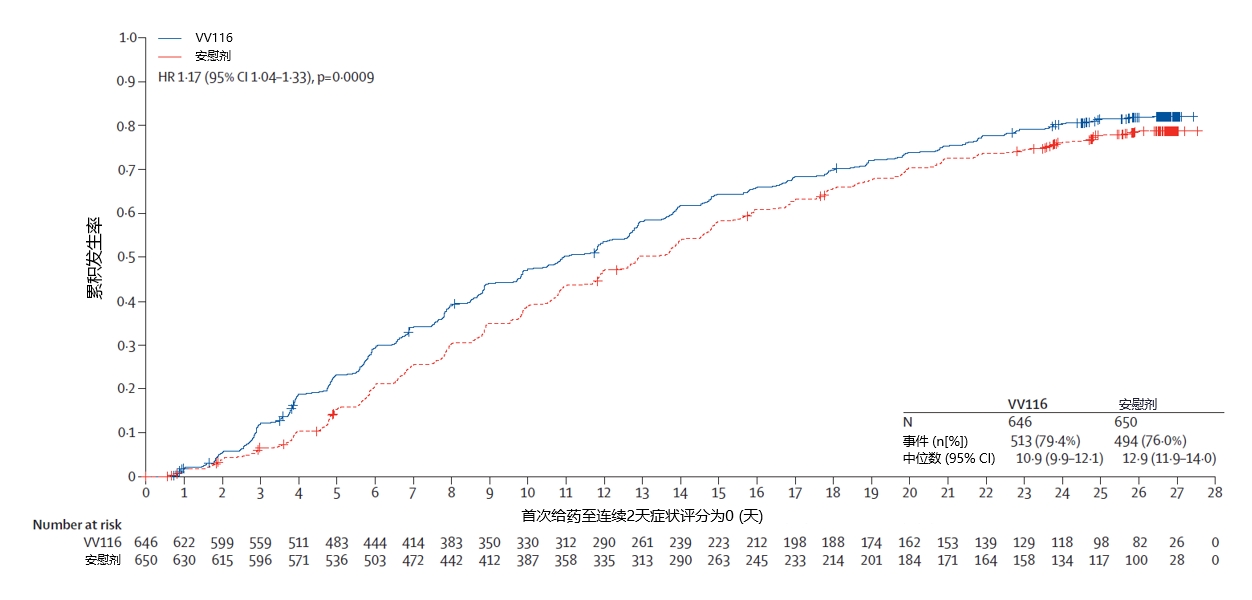
此外,截至給藥第5天,接受民得維®治療的患者病毒轉陰比例明顯高於安慰劑組(41.6% vs 31.1%,P<0.0001),民得維®組的病毒Ct值上升速度以及病毒載量下降速度也較安慰劑組更快。值得注意的是,研究結果表明,無論患者是否伴有進展為重症的高風險因素,或是否接種過新冠疫苗,均可實現明顯獲益。研究期間,安慰劑組有1例患者進展為重症,而民得維®組沒有患者進展為重症,兩組均未出現死亡。民得維®在各人群中(包括老年患者)的安全性良好,不良事件(AE)發生率與安慰劑相似。
本次試驗的研究物件同時納入了普通人群和伴有進展為重症的高風險因素人群,也覆蓋了不同的奧密克戎變異株,能夠更加全面、客觀地體現民得維®在現實場景中的臨床應用價值。在納入主分析集的1296例(民得維®組646例,安慰劑組650例)患者中,中位年齡為35.0歲,有558例(43.1%)患者伴有高風險因素。研究入組期間進行的病毒遺傳變異檢測結果顯示,患者感染的奧密克戎變異株以BA.5.2.48和BF.7.14為主要變體亞型。
綜合此前《新英格蘭醫學雜誌》發表的民得維®“頭對頭”對比3CL抑制劑“P藥”(奈瑪特韋片/利托那韋片組合包裝)的Ⅲ期臨床研究(NCT05341609)成果,民得維®具有非常明確的抗病毒效果,能夠有效治療伴或不伴有進展為重症的高風險因素的輕、中度COVID-19成人患者,可顯著加速症狀緩解和消失、縮短病程,且相較P藥的適用人群更廣,尤其是對於因患有合併症需要服用多種藥物的患者,民得維®的藥物相互作用更少。
君實生物全球研發總裁鄒建軍博士表示:“迄今為止,包括多項國內外大型Ⅲ期研究在內,全球已有超過3000例患者參與民得維®的研究,為民得維®在更廣泛人群中的應用提供了扎實的資料支援,也讓該藥物成為目前循證證據最充分的國產新冠口服藥之一。一年內兩次登上國際頂級醫學期刊,是對民得維®研究團隊的科研水準、研發品質的高度認可,我們對此感到非常自豪。國產新冠創新藥的崛起,是我國醫藥產業創新發展成果的重要體現之一,是對保障人民群眾生命安全和身體健康的有力踐行。君實生物將攜手各方繼續前行,助力產業發展、造福更多患者!”
【參考文獻】
1. Xiaohong Fan, Xiahong Dai, Yun Ling, et al. Oral VV116 versus placebo in patients with mild-to-moderate COVID-19 in China: a multicentre, double-blind, phase 3, randomised controlled study. The Lancet Infectious Diseases. DOI:10.1016/S1473-3099(23)00577-7.
1. 本材料旨在传递前沿信息,无意向您做任何产品的推广,不作为临床用药指导。
2. 若您想了解具体疾病诊疗信息,请遵从医疗卫生专业人士的意见与指导。
關於民得維®(氫溴酸氘瑞米德韋片,VV116/JT001)
VV116是一款口服核苷類藥物,可抑制SARS-CoV-2複製。臨床前藥效學研究顯示,VV116在體外對包括奧密克戎在內的新冠病毒原始株和突變株表現出顯著的抗病毒作用;在小鼠模型上,低劑量的VV116就可將肺部病毒滴度降低至檢測限以下,可顯著改善肺組織病理變化,表現出較強的抗病毒功效。臨床前的藥代動力學等研究結果顯示,VV116具有很高的口服生物利用度,其口服吸收後,迅速代謝為母體核苷,並在體內組織廣泛分佈。
VV116由中國科學院上海藥物研究所、中國科學院武漢病毒研究所、中國科學院新疆理化技術研究所、中國科學院中亞藥物研發中心/中烏醫藥科技城(科技部“一帶一路”聯合實驗室)、臨港實驗室、蘇州旺山旺水生物醫藥有限公司(旺山旺水)和君實生物共同研發。
在新冠疫情期間,VV116開展了多項國際多中心臨床試驗。 1項在伴有進展為重症高風險因素的輕中度COVID-19患者中對比PAXLOVID用於輕中度COVID-19早期治療的Ⅲ期臨床研究(JT001-010)獲得國際權威期刊《新英格蘭醫學雜誌》(The New England Journal of Medicine)發表[1],另1項在伴或不伴有進展為重症高風險因素的輕中度COVID-19患者中開展的Ⅲ期臨床研究(JT001-015)獲得國際頂尖感染病學期刊《柳葉刀-感染病學》(The Lancet Infectious Diseases)發表[2]。
2021年12月,VV116在烏茲別克斯坦獲得批准用於治療中/重度COVID-19患者。
2023年1月,VV116在中國獲得批准用於治療輕中度COVID-19的成年患者。